हिन्दी में अम्ल, क्षार एवं लवण का Basic Concept
अम्ल, क्षारक एवं लवण
अपने पिछली कक्षाओं में अध्ययन किया होगा कि भोजन का खट्टा एवं कड़वा स्वाद भोजन में विद्यमान क्रमश: अम्ल एवं क्षारक के कारण होता है। यदि आपके परिवार का कोई सदस्य अत्यधिक भोजन करने के कारण अम्लता से पीड़ित है तो आप कौन सा उपचार सुझाएँगे? नींबू पानी, सिरका या बेकिंग सोडा का विलयन?
- उपचार बताते समय आप किस गुणधर्म का ध्यान रखेंगे? आप जानते हैं कि अम्ल एवं क्षारक एक दूसरे के प्रभाव को समाप्त करते हैं। आपने अवश्य ही इसी जानकारी का उपयोग किया होगा।
- याद कीजिए कि कैसे हमने बिना स्वाद चखे ही खट्टे एवं कड़वे पदार्थों की जाँच की थी।
आप जानते हैं कि अम्लों का स्वाद खट्टा होता है तथा यह नीले लिटमस पत्र को लाल कर देते हैं। जबकि क्षारकों का स्वाद कड़वा होता है एवं यह लाल लिटमस पत्र को नीला कर देते हैं। लिटमस एक प्राकृतिक सूचक होता है।
इसी प्रकार हल्दी (turmeric) भी एक ऐसा ही सूचक है। क्या आपने कभी ध्यान दिया है कि श्वेत कपड़े पर लगे सब्जी के दाग पर जब क्षारकीय प्रकृति वाला साबुन रगड़ते हैं तब उस धब्बे का रंग भूरा-लाल हो जाता है? लेकिन कपड़े को अत्यधिक जल से धोने के पश्चात् वह फिर से पीले रंग का हो जाता है। अम्ल एवं क्षारक की जाँच के लिए आप संश्लेषित (synthetic) सूचक जैसे मेथिल ऑरेंज (methyl orange) एवं फोनॉल्फथेलिन (phenolphthalein) का भी उपयोग कर सकते हैं।
इस अध्याय में हम अम्ल एवं क्षारक की अभिक्रियाओं के बारे में अध्ययन करेंगे।
हमें जानकारी प्राप्त होगी कि अम्ल एवं क्षारक कैसे एक दूसरे के प्रभाव को समाप्त कर देते हैं। साथ ही दैनिक जीवन में पायी जाने वाली तथा उपयोग में आने वाली बहुत सी रोचक वस्तुओं के बारे में भी हम अध्ययन करेंगे।
अम्ल एवं क्षारक धातु के साथ कैसे अभिक्रिया करते हैं?
अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है। अभिक्रिया को इस प्रकार लिख सकते हैं:
NaOH(aq) + HCl(aq) → NaCl(aq) + H,O(1)
अम्ल एवं क्षारक की अभिक्रिया के परिणामस्वरूप लवण तथा जल प्राप्त होते हैं तथा इसे उदासीनीकरण अभिक्रिया कहते हैं। सामान्यत: उदासीनीकरण अभिक्रिया को इस प्रकार लिख सकते हैं:
क्षारक+अम्ल→लवण+जल
- अम्ल क्या है सूत्र लिखिए?
- क्षारक स्वाद में कैसे होते हैं? PDF
- अम्ल कौन कौन से होते हैं?
- लवण क्या है उदाहरण दीजिए?
- क्षारीय ऑक्साइड क्या है?
Download One liner Chemistry Notes
- अम्ल-क्षारक सूचक रंजक या रंजकों के मिश्रण होते हैं जिनका उपयोग अम्ल एवं क्षारक की उपस्थिति को सूचित करने के लिए किया जाता हैI
- विलयन में F+ (aq) आयन के निर्माण के कारण ही पदार्थ की प्रकृति अम्लीय होती है। विलयन में OH– (aq) आयन के निर्माण से पदार्थ की प्रकृति क्षारकीय होती है।
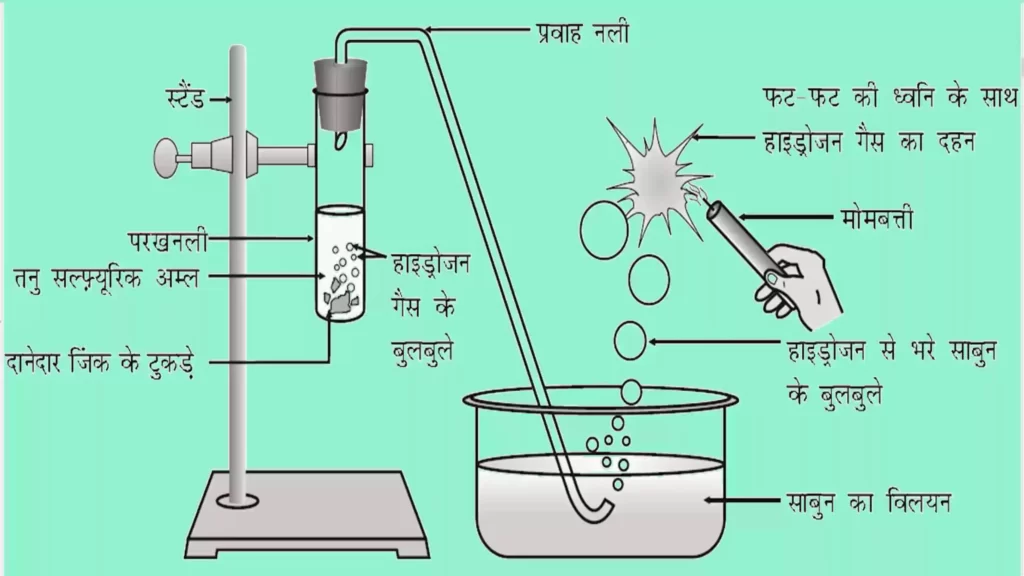
- जब कोई अम्ल किसी धातु के साथ अभिक्रिया करता है तो हाइड्रोजन गैस का उत्सर्जन होता है। साथ ही संगत लवण का निर्माण होता है।
- जब क्षारक किसी धातु से अभिक्रिया करता है तो हाइड्रोजन गैस के उत्सर्जन के साथ एक लवण का निर्माण होता है जिसका ऋण आयन एक धातु एवं ऑक्सीजन के परमाणुओं से संयुक्त रूप से निर्मित होता है।
- जब अम्ल किसी धातु कार्बोनेट या धातु हाइड्रोजनकार्बोनेट से अभिक्रिया करता है तो यह संगत लवण कार्बन डाइऑक्साइड गैस एवं जल उत्पन्न करता है।
- जल में अम्लीय एवं क्षारकीय विलयन विद्युत का चालन करते हैं क्योंकि ये क्रमशः हाइड्रोजन एवं हाइड्रॉक्साइड आयन का निर्माण करते हैं।
- अम्ल या क्षारक की प्रबलता की जाँच pH (0-14) स्केल के उपयोग से की जा सकती है जो विलयन में हाइड्रोजन आयन की सांद्रता की माप होता है।
- एक उदासीन विलयन के pH का मान 7 होता है जबकि अम्लीय विलयन के pH का मान 7 से कम एवं क्षारकीय विलयन के pH का मान 7 से अधिक होता है।
- सभी जीवों में उपापचय की क्रिया pH की एक इष्टतम सीमा में होती है।
- सांद्र अम्ल या क्षारक को जल के साथ मिश्रित करना एक अत्यन्त ऊष्माक्षेपो अभिक्रिया है।
- अम्ल एवं क्षारक एक-दूसरे को उदासीन करके लवण एवं जल का निर्माण करते हैं।
- लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
- हमारे दैनिक जीवन एवं उद्योगों में लवण के कई उपयोग हैं।